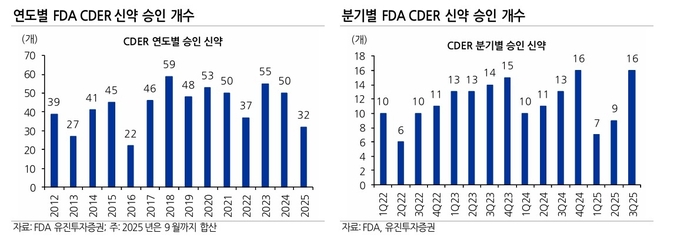
 [유진투자증권=권해순 연구원] 2025년 3분기에는 16개의 신약이 FDA 승인을 받으면서 상반기 승인 건수를 훌쩍 뛰어 넘었다.
[유진투자증권=권해순 연구원] 2025년 3분기에는 16개의 신약이 FDA 승인을 받으면서 상반기 승인 건수를 훌쩍 뛰어 넘었다.
3분기 승인 신약 중 브렌소카팁, 키트루다 큐렉스, 레미브루티닙이 블록버스터 의약품 후보군으로 주목받고 있다. 4분기에는 경구용 위고비, 아피캄텐의 신약 승인이 기대되고 있다.
◆ 3분기 FDA 승인 신약들 이것”
2025년 3분기에는 항암제 6개, 희귀질환 치료제 3개 등 총 16개의 신약이 FDA CDER(Center for Drug Evaluation and Research) 승인을 받았다. 1분기와 2분기에 각각 7개와 9개의 신약 승인이 있었다는 것을 감안할 때 큰 폭 증가한 수준이다.
대부분이 저분자 화합물이며 이중항체 1개, ASO 1개, SC제형 1개 등이 승인을 받았다. 빅파마 중에는 리제네론, 베링거 잉겔하임, 아이오니스, 사노피, MSD, 일라이 릴리, 노바티스의 신약이 FDA 승인을 받았다.
키트루다 큐렉스(제품명 Keytruda Qlex, 성분명 pembrolizumab/berahyaluronidase alfa-pmph)의 경우 글로벌 매출액 1위 의약품인 항암제 키트루다에 알테오젠의 ALT B-4 기술이 적용된 SC제형 치료제다.
MSD는 2년 내에 키트루다IV 투여 환자의 30~40%가 SC로 전환될 것으로 전망하고 있다. 알테오젠은 키트루다 큐렉스 매출 발생 이후 2026년부터 마일스톤이 본격적으로 유입되며 경상적인 실적이 발생할 전망이다.
판매액의 일정 비율로 유입되는 판매 로열티는 최대 10억 달러에 달하는 마일스톤 회수 후 유입될 예정이다. 마일스톤 회수 기간은 약 3~4년 정도로 추정된다.
던제라(Dawnzera, donidalorsen)은 아이오니스(NASDAQ.IONS)의 ASO 기반 혈관성부종(희귀질환) 치료제다. 아이오니스는 던제라의 매출액을 $500mn 이상으로 제시했다.
아이오니스는 2024년 승인받은 트린골자(성분명 올레자르센)의 적응증을 sHTG(중증 고중성지방혈증)으로 확장하여 추가 승인을 받을 예정이다.
따라서 2026년 이후 실적 고성장이 예상되고 있다. 트린골자의 peak sales는 $2bn을 상회할 것으로 전망되고 있으며 두 신약 모두 국내 에스티팜이 원료를 공급한다.
허넥세오스(Hernexeos, zongertinib)의 경우 HER2 변이 비소세포폐암 치료제 중 최초의 경구 제형으로 가속 승인 받았다. 현재 HER 2 변이를 타겟하는 치료제는 엔허투(ADC기전) 밖에 없어서 복용의 편의성, 내성 극복 대안 치료제로 자리를 잡았다.
1차 치료제로 승인받기 위해서는 추가 임상이 필요하다. 국내 기업 중에서는 보로노이(VRN10, 한국/호주 임상1상), 유한양행(YH42946, 한국/미국 임상1/2상) 등이 개발 중에 있다.
◆ 약 50개 신약 승인 기대”
브린수프리(Brinsupri, brensocatib)의 경우 First-in-class DPP1 저해제이자 최초의 비낭성 섬유증성 기관지 확장증 치료제다. 개발사 인스메드(NASDAQ.INSM)는 브린수프리의 peak sales가 $5bn를 상회할 것으로 전망하고 있다.
FDA 승인 신약 2개를 보유한 인스메드는 시가총액 $30bn를 상회하며 시가총액 기준 글로벌 제약사 33위로 올라선 상태다.
4분기 FDA 신약 승인이 기대되는 블록버스터 후보군은 경구용 세마글루타이드 제제(Oral Wegovy)와 아피캄텐(Aficamten, Cytokinetics 개발) 등이 있다. 2025년에도 2024년과 유사한 약 50개의 신약이 승인될 것으로 기대된다.


